带来nature communications 上的一篇文章,Proteomics of protein trafficking by in vivo tissue-specific labeling,文章通讯作者是来自哈佛医学院的Ilia A. Droujinine和Norbert Perrimon. Norbert Perrimon课题组主要是利用基因组学和蛋白质组学等各种技术对生物体内器官间在稳态和应激状态下的蛋白质通讯机制进行研究。而Ilia A. Droujinine是他们组的博士毕业生,现在就职于哈佛医学院。
近些年有关局部组织中稳态研究越来越多,然而对血液和组织器官之间分泌因子(通讯因子)生理功能的研究才刚刚开始。分泌因子通过血液循环从产生部位运输到远端器官,例如瘦素和脂联素等脂肪因子作用于大脑和其他器官的脂肪代谢调节。此外,肌细胞因子如白细胞介素-6由肌肉分泌并控制脂肪组织的代谢。尽管这些通讯因子很重要,但对于它们如何在组织间传递和关联还不清楚,因为缺乏有效的大规模筛选方法,“有多少蛋白质在任何两个器官之间转移”这个一直以来的问题还在困扰着科学家们。液相色谱-串联质谱法(LC-MS/MS)是鉴定血液中分泌因子的有力方法,但它也存在着一定的局限,因为未经处理的血液样本极其复杂,蛋白质浓度动态范围很大,高峰度蛋白占大多数,这使得低丰度蛋白质的鉴定具有挑战性。此外,在血液或细胞培养液中鉴定不能确定分泌蛋白的来源和目的地。

在本文工作中,为了克服这些局限性,作者开发了一个利用生物素连接酶(BirA*G3)鉴定器官间分泌性蛋白运输的平台。在体内通过工程化的生物素连接酶BirA*G3对特定组织分泌的蛋白质标记上生物素,然后远端器官进行亲和富集,通过定量LC–MS/MS进行鉴定。通过此方法,作者将蛋白质组简化为参与组织间转运的候选蛋白质鉴定,来确定它们的来源和目的地。在果蝇模型中,作者利用此方法鉴定了51种来自头部的肌肉分泌蛋白和269种来自腿部肌肉的分泌蛋白,其中60-70%具有人类同源基因。其中就包括FB信号蛋白,它们具有已知的受体,并被证明与具有特定模式的肌肉结合。作者通过进一步研究证明了一种保守的FB衍生的组织间通讯因子CG2145(人类同源基因:ENDOU)促进肌肉活动,并以特定的模式直接结合到肌肉上(靠近肌肉/神经元),但不结合到其他器官。这些结果表明,本文的方法可以鉴定特定的远程分泌蛋白。为了研究这种方法在哺乳动物系统中的潜力,作者在小鼠胚胎干细胞(ESCs)中引入BirA*G3,并在ESC衍生的畸胎瘤和宿主血清样本中分析生物素标记的蛋白。结合TMT的定量串联质谱分析表明肿瘤和血清样本之间有共同的分泌蛋白。在富集到的291种血清蛋白中,还包含了几种具有激素性质的低丰度蛋白。

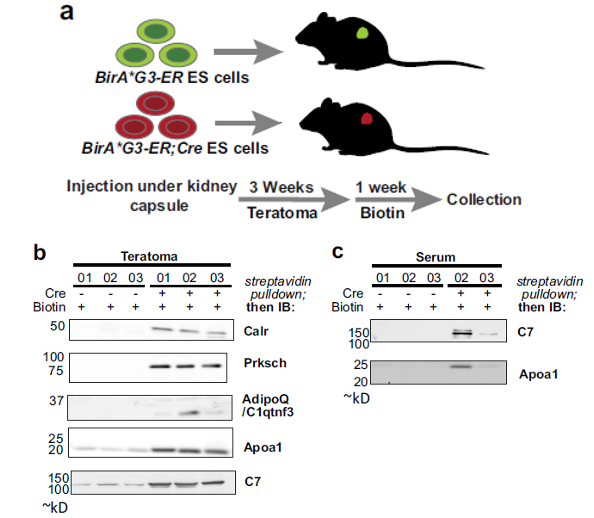
作者的研究揭示了分泌蛋白的通讯网络是广泛的,为候选的组织间通讯因子提供了数据库资源。本文采用的BirA*G3方法在不同的模型系统中具有广泛的潜力,可以识别健康或疾病状态下的细胞分泌体和机体间通讯介质。
本文作者:ZYL
责任编辑:LYP
原文链接:https://www.nature.com/articles/s41467-021-22599-x
原文引用:DOI:10.1038/s41467-021-22599-x








目前评论: